南京赛戈巍生物科技有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
浅谈铁死亡与铜死亡丨一篇关于细胞如何“黑化”与我们如何“策反”它们的综述
44 人阅读发布时间:2025-11-20 14:59
如果细胞世界也有“重金属灾难片”,那铁死亡和铜死亡绝对是票房霸主——它们带来的不是视听,而是实打实的“细胞级”危机。
程序性细胞死亡是调节细胞稳态和清除受损细胞的关键过程。在各种程序性细胞死亡形式中,铁死亡和铜死亡是两种不同但又相互关联的机制。铁死亡是一种铁依赖性的细胞死亡形式,其特征是脂质过氧化和氧化应激的累积;而铜死亡则由铜的积累及其对细胞系统的毒性作用所驱动。这两个过程都与多种疾病有关,包括癌症、神经退行性疾病和心血管疾病。
细胞死亡对于维持细胞稳态和正常的组织功能至关重要。传统上,细胞凋亡、坏死和自噬是受调控细胞死亡的主要形式。然而,最近的研究发现了其他受调控细胞死亡形式,包括铁死亡和铜死亡,它们由不同的生化过程驱动,并与多种病理状况有关。铁死亡于 2012 年首次被描述,而铜死亡,一种铜依赖性的细胞死亡形式,于 2022 年才被发现。这两个过程都涉及独特的分子通路,它们的相互作用带来了激动人心的治疗可能性。
以下将探讨铁死亡和铜死亡的分子机制、相互联系、它们在疾病发病机制的新进展,以及这些细胞死亡调控形式的潜在治疗策略。
PART1
铁死亡:机制与调控
铁死亡(Ferroptosis)是一种铁依赖性程序性细胞死亡,不同于细胞凋亡和坏死,铁死亡的主要机制特征包括:
1、脂质过氧化和氧化应激
铁死亡的主要特征是脂质过氧化物的积累,特别是在易受氧化损伤的含多不饱和脂肪酸 (PUFA) 的磷脂中。脂质氢过氧化物的积累,尤其是在细胞膜上的积累,会导致细胞功能障碍和死亡。铁会促进这种氧化损伤,因为它会通过芬顿反应(Fenton chemistry)促进活性氧 (ROS) 的生成。
2、铁代谢和GPX4的作用
细胞铁的积累是铁死亡的关键步骤。铁参与芬顿反应,其中亚铁离子 (Fe²⁺ )催化过氧化氢 ( H₂O₂ )转化为高活性羟基自由基 ( • OH ),进而引发脂质过氧化。谷胱甘肽过氧化物酶 4 (GPX4) 在谷胱甘肽 (GSH) 的辅助作用下,将脂质氢过氧化物还原为相应的醇,在减轻脂质过氧化方面发挥着关键作用。GPX4 的抑制或耗竭会导致脂质过氧化物的积累,引发铁死亡。
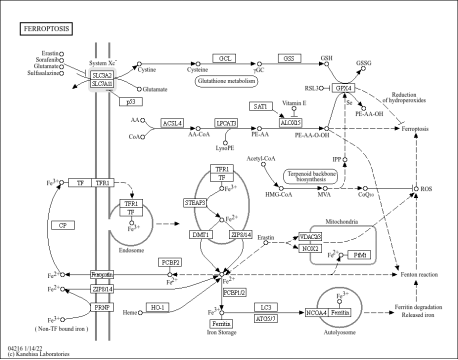
Ferroptosis Pathway(from KEGG)
3、铁死亡的关键调控因子
多种蛋白质和基因通过铁稳态、抗氧化防御和脂质代谢来调节铁死亡。关键的铁死亡相关蛋白质包括:
⚫ SLC7A11 :半胱氨酸/谷氨酸反向转运系统的关键组成部分,调节细胞谷胱甘肽(GSH)水平。SLC7A11的下调可增强铁死亡敏感性。
⚫ ACSL4和LPCAT3:这两种酶都参与将 PUFA 掺入磷脂中,磷脂是脂质过氧化的主要底物。
⚫ TFRC和FTH1:分别是铁的输入和储存蛋白,负责调节细胞内铁水平。TFRC 的过表达会促进铁死亡,FTH1 则会抑制铁死亡 。
PART2
铜死亡:一种新的铜依赖性细胞死亡形式
铜死亡(Cuprotosis)是一种依赖铜的程序性细胞死亡形式,最近被确认为与铁死亡和细胞凋亡截然不同的过程。相对由铁驱动的铁死亡有所不同,铜死亡是由铜的积累引发的,导致线粒体功能障碍和细胞死亡。
1、铜诱导毒性的机制
铜是许多酶的必需辅因子,包括细胞色素c氧化酶和超氧化物歧化酶(SOD1)。然而,过量的铜积累会通过形成活性氧(ROS)并破坏线粒体功能而导致细胞毒性。最近的研究表明,铜与线粒体丙酮酸脱氢酶复合物(PDC)的脂酰化成分结合,导致复合物不稳定并增加ROS生成。这一过程会导致线粒体功能障碍、ATP生成丧失以及细胞死亡途径的激活,包括铜凋亡。
2、线粒体功能障碍的作用
铜诱导的线粒体复合体(PDC)和其他线粒体复合物的破坏会导致细胞能量产生减少、活性氧(ROS)生成增加以及线粒体完整性受损。由此产生的氧化应激和线粒体损伤会激活细胞死亡途径,包括坏死和自噬,从而导致铜死亡。
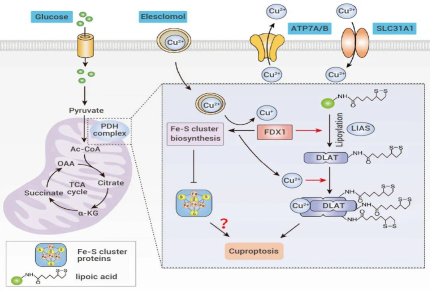
Wang, Y.et al., Cuproptosis: a new form of programmed cell death. Cell Mol Immunol 19, 867–868 (2022).
3、铜死亡的分子机制
⚫ 脂酰化蛋白质
(Lipoylated Proteins):铜与线粒体中的脂酰化蛋白质(尤其是PDC中的蛋白质)的结合是诱导铜死亡的关键。
⚫ 铜转运蛋白
(Copper Transporters):ATP7A和CTR1等铜转运蛋白调节铜进入细胞,而ATP7B则控制铜的流出。这些转运蛋白的失调会导致铜超载并随后产生毒性。
PART3
铁死亡和铜死亡的相互作用
最近的研究表明,铁死亡和铜死亡在其潜在机制上存在相似之处,尤其是在氧化应激和线粒体功能障碍方面。这两个过程均由金属诱导的毒性引发,铁和铜在活性氧(ROS)的产生和细胞死亡的诱导中起着关键作用。此外,铜已被证明通过影响铁死亡相关基因和酶的表达来影响铁死亡。
然而,这两个过程也表现出不同的特征。铁死亡与脂质过氧化和铁稳态更密切相关,而铜死亡主要涉及线粒体功能障碍和铜依赖性蛋白质不稳定。铜和铁在生成活性氧(ROS)方面的协同作用,在某些条件下也可能加剧这两种细胞死亡形式。
PART4
疾病影响和治疗策略
铁死亡与铜死亡都对疾病病理学具有重要意义,包括癌症、神经退行性疾病和心血管疾病。
1、癌症
在癌症治疗中,铁死亡已被提议作为一种克服常规疗法耐药性的治疗策略。诱导铁死亡的药物,例如铁抑制剂(ferrostatins) 和利普罗司他汀(liproxstatin-1)在临床前模型中已显示出良好的前景。另一方面, 铜死亡可能通过利用铜的积累和线粒体功能障碍提供一种靶向癌细胞的新方法。
2、神经退行性疾病
铁死亡和铜死亡都与神经退行性疾病有关。铁死亡会导致阿尔茨海默病和帕金森病等疾病的神经元损伤,这些疾病的显著特征是氧化应激和金属失调。铜过载也与神经退行性疾病有关,例如威尔逊氏病,其特征是铜在脑内积聚 。
3、心血管疾病
铁死亡和铜死亡与心血管疾病相关,包括心肌梗死和动脉粥样硬化。铁死亡与缺血再灌注后的心肌损伤有关,而铜诱导的毒性可加剧血管细胞的氧化损伤。
4、治疗方法
【铁死亡调节】铁死亡诱导剂和抑制剂具有治疗潜力。铁死亡抑制剂和利普罗司他汀是抑制铁死亡的小分子,已在神经退行性疾病和缺血的临床前模型中展现出良好的前景 。
【铜螯合剂】铜螯合剂,例如四硫代钼酸盐,已在癌症和神经退行性疾病的临床试验中得到验证。这些药物旨在降低铜诱导的毒性并预防铜死亡。
总结
铁死亡和铜死亡代表两种不同的受调控的细胞死亡形式,分别由金属诱导的氧化应激和线粒体功能障碍驱动。近期研究进一步揭示了他们的分子机制,突出了它们在各种疾病中的作用,并提供了新的治疗机遇。靶向铁死亡和铜死亡有望为癌症、神经退行性疾病和心血管疾病等疾病的治疗带来希望。然而,仍需进一步研究以充分阐明这些过程之间的相互关联,并开发更有效的治疗方法。
● References
❶. Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., et al. (2012). Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 149(5), 1060-1072. doi.org/10.1016/j.cell.2012.03.042
❷. Kovacevic, Z., & Richardson, D. R. (2015). Copper and cancer: from the beginning to the end. BioMetals, 28(4), 705-718. doi.org/10.1007/s10534-015-9832-1
❸. Li, Y., Yu, J., Liu, Y., et al. (2019). Copper induces mitochondrial dysfunction and cell death in human neuroblastoma SH-SY5Y cells. Neurotoxicology, 74, 133-142. doi.org/10.1016/j.neuro.2019.01.002
❹. Stockwell, B. R., Friedmann Angeli, J. P., Bayir, H., et al. (2017). Ferroptosis: A regulated cell death nexus linking metabolism, redox biology, and disease. Cell, 171(2), 273-285. doi.org/10.1016/j.cell.2017.09.021
❺. Tsvetkov, P., Coy, S. L., et al. (2022). Copper induces a novel form of cell death through mitochondrial lipoylation. Nature, 608, 774-779. doi.org/10.1038/s41586-022-04818-x
❻. Vidal, V., Sarria, T., & Rodríguez-Casado, A. (2020). Copper and iron interplay in ferroptosis. Cell Death & Disease, 11, 1066. doi.org/10.1038/s41419-020-03050-w
❼. Zhang, S., Wang, T., et al. (2020). Copper ions promote atherosclerosis via ferroptosis. Nature Communications, 11, 4169. doi.org/10.1038/s41467-020-18066-8
❽. Wang, Y., Zhang, L. & Zhou, F. Cuproptosis: a new form of programmed cell death. Cell Mol Immunol 19, 867–868 (2022). doi.org/10.1038/s41423-022-00866-1